|
Votre recherche : CYPHER SELECT PLUS
Dossier d'information Euro-Pharmat
Dispositif médical

|
Dossier d'information Euro-Pharmat
Dispositif médical
|
| CYPHER SELECT PLUS |
| |
|
|
Date de mise à jour : |
12/04/2011 16:18:30
|
| 1. Renseignements administratifs concernant l'entreprise |
| 1.1 |
Nom : |
CORDIS |
| 1.2 |
Adresse : |
TSA 71001
1 rue Camille Desmoulins
92787 ISSY LES MOULINEAUX Cedex 9
|
| Tél. : |
01 55 00 33 00 |
| Fax : |
01 55 00 28 30 |
| e-mail : |
|
| Site : |
http://www.johnsonandjohnson.com
|
| 1.3 |
Correspondant matériovigilance : |
Mme BRUNEL Pascale |
| Tél. : |
01 55 00 27 27 |
| Fax : |
01 55 00 28 34 |
| e-mail : |
complaintsharedservices@jnjfr.jnj.com
|
| 2. Informations sur dispositif ou équipement |
| 2.1 |
Dénomination commune selon la nomenclature Euro-Pharmat : |
ENDOPROTHESE CORONAIRE |
| 2.2 |
Dénomination commerciale : |
CYPHER SELECT PLUS |
| 2.3 |
Code Nomenclature : |
46535 |
| Code CLADIMED : |
|
| 2.4 |
Code LPPR* (Ex TIPS) si applicable :
* Liste des produits et prestations remboursables inscrits sur la liste prévue à l'article L165-1
|
voir annexe |
| 2.5 |
Classe du DM : |
III |
| Directive de l'UE applicable : |
directive 93/42/CEE, Selon Annexe n° II, section 4 |
| N° Organisme notifié : |
0086 |
| Première mise sur le marché dans l'UE : |
01/01/2006 |
| Fabricant : |
Cordis Cashel |
| 2.6 |
Descriptif du dispositif : |
|
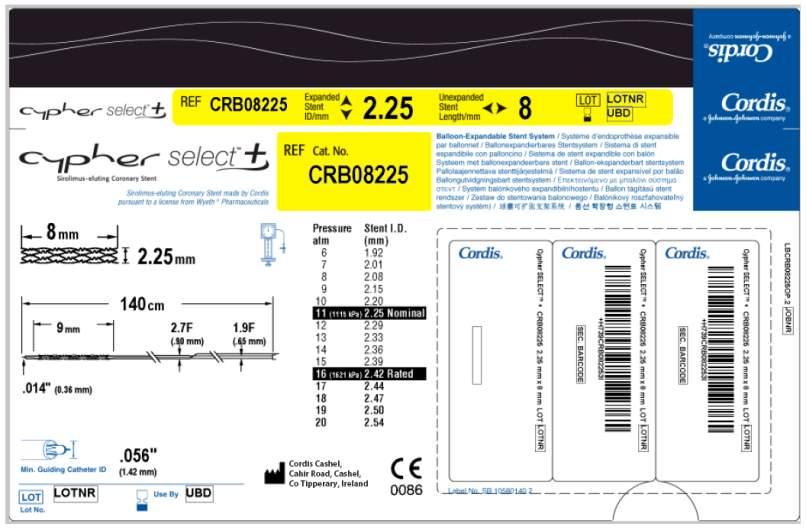
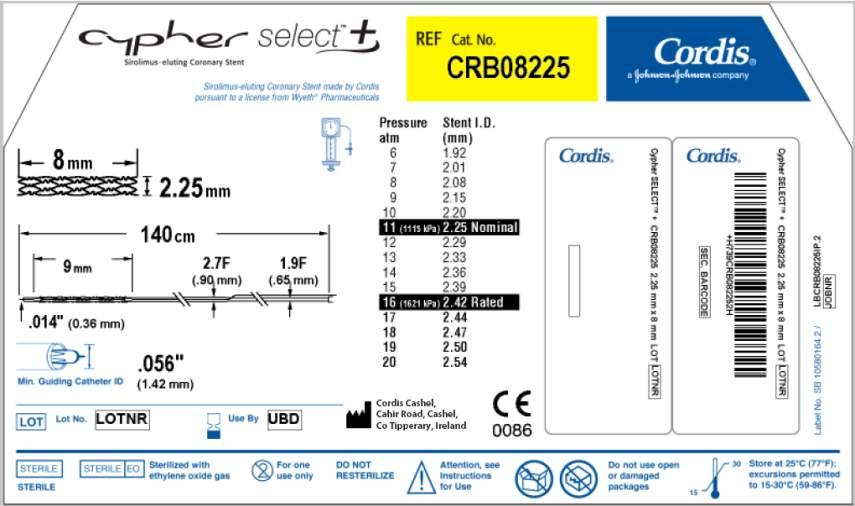
| o Endoprothèse tubulaire disponible en 8, 13, 18, 23, 28 et 33 mm de longueur et en 2,25, 2,50, 2,75, 3,00 et 3,50 mm de diamètre.
o Ballonnet d’insertion DURALYN® serti à l’extrémité distale du cathéter (sertissage à chaud) avec profil du système serti.
crimped profile (inch) nominal stent diameter (mm)
0.044 2.25
0.045 2.50
0.046 2.75
0.047 3.00
0.053 3.50
o La longueur utile du système d’insertion est de 140 cm et sa tige présente un profil allant de 1,9F (0,64 mm) (extrémité proximale) à 2,7F (0,90 mm) (extrémité distale). À environ 25 cm de son extrémité distale, le cathéter possède un port (orifice) distal, qui donne accès à la lumière du guide. Celle-ci débute au niveau du port distal et s’étend jusqu’à l’extrémité distale. Un marqueur situé sur la tige distale identifie le port distal.
o Le cathéter comporte également, sur sa tige proximale, deux marqueurs radio-opaques qui indiquent approximativement l’endroit où l’extrémité du cathéter à ballonnet sort du cathéter guide (artère brachiale : 90 cm ; artère fémorale : 100 cm).
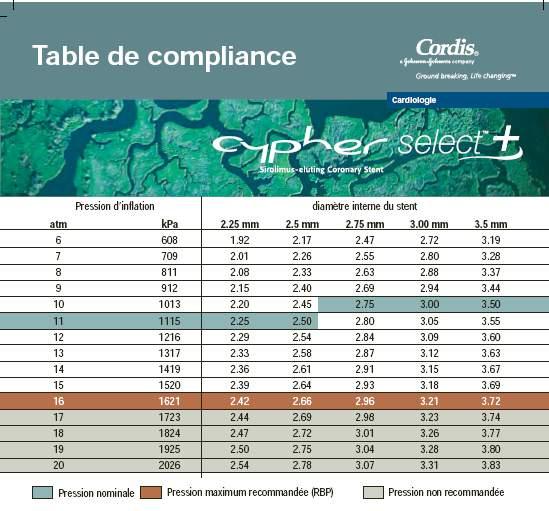
o La pression nominale est de 10 à 11 atm selon le diamètre du stent, la pression maximale recommandée (RBP) de tous les ballonnets est de 16 atm et la compliance deu ballonnet de 7% en moyenne (voir table de compliance en annexe 2).
o Epaulement du ballon sur le stent : 0.5 mm de chaque coté du stent.
o La dose de médicament sur une endoprothèse est de 140 µg/cm2, avec un maximum de 419 µg sur le plus grand modèle (3,50 x 33 mm).
o Epaisseur globale du stent : 152,6 µm dont le stent représente 140 µm et le polymère 12,6 µm
o Le ratio métal artère est de 12 à 19%
o Raccourcissement longitudinal après expansion inférieur ou égal à 0.3 mm
o Retour élastique.
Diamètre (mm) stent recoil (mm)
2.25 0.10
3.00 0.10
3.50 0.11 |
| 2.7 |
Références catalogue : |
|
Référence :
CRB08225
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 8 mm
-DIAMETRE STENT : 2,25 mm
|
Référence :
CRB08250
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 8 mm
-DIAMETRE STENT : 2,5 mm
|
|
Référence :
CRB08275
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 8 mm
-DIAMETRE STENT : 2,75 mm
|
Référence :
CRB08300
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 8 mm
-DIAMETRE STENT : 3 mm
|
|
Référence :
CRB08350
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 8 mm
-DIAMETRE STENT : 3,5 mm
|
Référence :
CRB13225
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 13 mm
-DIAMETRE STENT : 2,25 mm
|
|
Référence :
CRB13250
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 13 mm
-DIAMETRE STENT : 2,5 mm
|
Référence :
CRB13275
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 13 mm
-DIAMETRE STENT : 2,75 mm
|
|
Référence :
CRB13300
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 13 mm
-DIAMETRE STENT : 3 mm
|
Référence :
CRB13350
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 13 mm
-DIAMETRE STENT : 3,5 mm
|
|
Référence :
CRB18225
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 18 mm
-DIAMETRE STENT : 2,25 mm
|
Référence :
CRB18250
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 18 mm
-DIAMETRE STENT : 2,5 mm
|
|
Référence :
CRB18275
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 18 mm
-DIAMETRE STENT : 2,75 mm
|
Référence :
CRB18300
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 18 mm
-DIAMETRE STENT : 3 mm
|
|
Référence :
CRB18350
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 18 mm
-DIAMETRE STENT : 3,5 mm
|
Référence :
CRB23225
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 23 mm
-DIAMETRE STENT : 2,25 mm
|
|
Référence :
CRB23250
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 23 mm
-DIAMETRE STENT : 2,5 mm
|
Référence :
CRB23275
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 23 mm
-DIAMETRE STENT : 2,75 mm
|
|
Référence :
CRB23300
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 23 mm
-DIAMETRE STENT : 3 mm
|
Référence :
CRB23350
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 23 mm
-DIAMETRE STENT : 3,5 mm
|
|
Référence :
CRB28225
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 28 mm
-DIAMETRE STENT : 2,25 mm
|
Référence :
CRB28250
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 28 mm
-DIAMETRE STENT : 2,5 mm
|
|
Référence :
CRB28275
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 28 mm
-DIAMETRE STENT : 2,75 mm
|
Référence :
CRB28300
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 28 mm
-DIAMETRE STENT : 3 mm
|
|
Référence :
CRB28350
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 28 mm
-DIAMETRE STENT : 3,5 mm
|
Référence :
CRB33225
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 33 mm
-DIAMETRE STENT : 2,25 mm
|
|
Référence :
CRB33250
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 33 mm
-DIAMETRE STENT : 2,5 mm
|
Référence :
CRB33275
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 33 mm
-DIAMETRE STENT : 2,75 mm
|
|
Référence :
CRB33300
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 33 mm
-DIAMETRE STENT : 3 mm
|
Référence :
CRB33350
Descriptif :
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 BOITE(S)
Caractéristique(s) :
-LONGUEUR STENT : 33 mm
-DIAMETRE STENT : 3,5 mm
|
|
| 2.8 |
Composition du dispositif et accessoires : |
| Principaux composants et matériaux :
|
ENDOPROTHESE
- ACIER 316 L
ENDOPROTHESE
- ACIER INOXYDABLE
REVETEMENT
- POLYMERE
|
| Substances actives : |
|
SIROLIMUS
|
|
Pour les composants suceptibles d'entrer en contact avec le patient et/ou les produits administrés, précisions complémentaires
|
| Latex : |
Non |
| Phtalates : |
Non |
| Origine animale ou biologique : |
Non |
| Dispositifs et accessoires associés (consommables captifs notamment) : |
| > Cathéter(s) guide(s) appropriée(s)
> 2-3 seringues de 10 à 20 cc
> 1000u/500cc de sérum physiologique normal hépariné stérile
> 1 guide de 0.36 mm de diamètre
> 1 valve hémostatique rotative de diamètre interne approprié
> du sérum physiologique normal
> 1 dispositif de gonflage
> 1 robinet d'arrêt (3 voies minimum)
> médicaments anticoagulants et anti-plaquettaires appropriés |
| 2.9 |
Domaines et indications (selon nomenclature Euro-Pharmat) : |
| Domaines : |
|
|
| Indications (Informations complémentaires au paragraphe 6) : |
LESION CORONAIRE
ANGIOPLASTIE CORONAIRE
RESTENOSE ARTERE CORONAIRE
OCCLUSION ARTERE CORONAIRE
STENOSE ARTERE CORONAIRE
STENTING DIRECT
DILATATION
|
| 4. Conditions de conservation |
| |
Conditions normales de conservation et de stockage : |
| Conserver à 25°C ; dépassements autorisés jusqu’à 15 °C et 30 °C.
|
| Précautions particulières : |
| |
| Durée de validité du produit : |
| 9 mois |
| Présence d'indicateurs de température (s'il y a lieu) : |
| non applicable |
| 5. Sécurité d'utilisation |
| 5.1 |
Sécurité technique : |
| Les essais non cliniques ont montré que l’utilisation d’une endoprothèse unique ou de deux endoprothèses chevauchantes CYPHER SELECT ® était compatible avec les techniques IRM, à des intensités de champ inférieures ou égales à 3 Tesla et à un débit d’absorption spécifique (DAS) maximum moyenné sur le corps entier de 3,0 W/kg pendant une IRM de 15 minutes. Dans un tel environnement d’IRM, l’endoprothèse unique ou les deux endoprothèses chevauchantes CYPHER SELECT TM ne devraient pas migrer. Aucun essai non clinique n’a été réalisé pour exclure la possibilité d’une migration des endoprothèses à des intensités de champ supérieures à 3 Tesla. Lors de ces essais, l’endoprothèse unique CYPHER SELECT® d’une longueur inférieure ou égale à 33 mm a produit une élévation de la température inférieure à 1 °C et les deux endoprothèses chevauchantes CYPHER SELECT ® de 33 mm de long ont produit une élévation de la température inférieure à 2 °C, à un DAS maximum moyenné sur le corps entier de 3,0 W/kg pendant une IRM de 15 minutes. Dans un environnement d’IRM, l’effet de la chaleur sur les endoprothèses dont les croisillons sont fracturés n’est pas connu. Dans un environnement d’IRM, l’effet de la chaleur sur l’enduit composé de sirolimus et de polymères n’est pas connu. La qualité de l’IRM peut être altérée si la zone d’intérêt se situe exactement dans la même zone que l’endoprothèse ou relativement près de sa position. |
| 5.2 |
Sécurité biologique (s'il y a lieu) : |
| conforme à la Directive 2003/32/CE de la Commission du 23 avril 2003 |
| 6. Conseils d'utilisation |
| 6.1 |
Mode d'emploi : |
| > Accès à l’emballage contenant le système stérile d’insertion de l’endoprothèse et inspection avant utilisation :
1. Avant l’ouverture, il convient d’inspecter soigneusement l’emballage du système d’insertion de l’endoprothèse afin de s’assurer que la barrière stérile est intacte. Ne pas utiliser si le conditionnement est endommagé de quelque manière que ce soit.
2. Déchirer l’étui en aluminium et sortir délicatement le produit emballé dans une bobine de feuillard et support cartonné. Faire glisser ou poser le produit dans le champ stérile en utilisant une technique aseptique.
3. Avant d’utiliser le dispositif, s’assurer qu’il n’est pas plié ni tordu, et n’est pas endommagé d’une quelconque autre manière.
> Préparation :
Rinçage du cathéter
Rincer le cathéter à l’aide de sérum physiologique hépariné stérile.
Rinçage de la lumière du guide
1. Connecter la seringue remplie de HepNS à l’aiguille de rinçage emballée dans le blister.
2. Insérer l’aiguille dans l’extrémité du cathéter et rincer la lumière du guide avec le HepNS.
Précaution: NE PAS manipuler l’endoprothèse durant le rinçage de la lumière du guide, afin de ne pas modifier son positionnement sur le ballonnet.
Préparation du système d’insertion
1. Préparer le dispositif de gonflage avec le milieu de contraste dilué.
2. Connecter le dispositif de gonflage au robinet d’arrêt ; connecter le robinet à l’embase (port de gonflage du ballonnet).
Précaution: à ce stade : NE PAS appliquer de pression, qu’elle soit négative ou positive, sur le ballonnet.
3. Ouvrir le robinet d’arrêt vers le système d’insertion de l’endoprothèse.
4. Laisser le dispositif de gonflage sous pression neutre.
> Procédure d’insertion :
1. Préparer le site d’accès vasculaire conformément aux pratiques standard.
2. Préparer le site de la lésion conformément aux pratiques standard.
3. Maintenir une pression neutre sur le dispositif de gonflage. Ouvrir la valve hémostatique rotative aussi largement que possible.
4. Enfiler le système d’insertion sur la position proximale du guide tout en maintenant la position du guide le long de la lésion cible.
5. Faire progresser le système d’insertion sur le guide jusqu’à la lésion cible. Utiliser les marqueurs radio-opaques du ballonnet pour positionner l’endoprothèse dans la lésion et confirmer son positionnement par angiographie.
Remarque: Lorsqu’une résistance inaccoutumée se fait sentir à un moment quelconque, que ce soit lors de la procédure d’acheminement vers le site de la lésion ou lors du retrait du système d’insertion avant implantation de l’endoprothèse, le système entier doit être retiré d’un seul tenant. Se reporter à la section Précautions à observer lors du retrait de l’endoprothèse/du système pour connaître les instructions spécifiques de retrait du système d’insertion.
> Procédure de déploiement :
1. Avant le déploiement, vérifier une nouvelle fois que l’endoprothèse est correctement positionnée par rapport à la lésion cible en se basant sur les marqueurs radio-opaques du ballonnet.
2. Connecter le dispositif de gonflage (seulement partiellement rempli de milieu de contraste) à un robinet d’arrêt (trois voies au minimum) et appliquer une pression négative pour purger l’air du ballonnet.
3. Fermer le robinet d’arrêt vers le cathéter et purger l’air du dispositif de gonflage. Fermer le port latéral du robinet d’arrêt.
4. Sous contrôle fluoroscopique, gonfler le ballonnet afin de déployer l’endoprothèse, mais ne pas dépasser la pression d’éclatement nominale indiquée. Une expansion optimale nécessite un contact continu entre l’endoprothèse et la paroi artérielle, le diamètre interne de l’endoprothèse correspondant à celui du vaisseau de référence. Le contact de la paroi de l’endoprothèse doit être vérifié par angiographie ou échographie intravasculaire de routine.
5. Dégonfler le ballonnet en appliquant une pression négative (vide) avec le dispositif de gonflage. S’assurer que le ballonnet est totalement dégonflé avant de tenter un quelconque mouvement du cathéter.
6. Vérifier l’expansion correcte de l’endoprothèse par injection angiographique à travers le cathéter guide.
> Dilatation complémentaire après l’implantation :
Tous les efforts doivent être mis en oeuvre pour s’assurer que l’endoprothèse est suffisamment gonflée. Si la taille de l’endoprothèse déployée demeure insuffisante par rapport au diamètre vasculaire, ou si le contact avec le vaisseau n’est pas satisfaisant, il est possible de procéder à une expansion complémentaire en utilisant un ballonnet de plus grande taille. Si les résultats angiographiques initiaux ne sont pas optimaux, une expansion complémentaire est encore possible au moyen d’un cathéter à ballonnet de faible profil, haute pression et sans compliance. Il est alors nécessaire de traverser délicatement le segment portant l’endoprothèse à l’aide d’un guide prolabé, afin de ne pas risquer de déloger l’endoprothèse.
Précaution: Ne pas dilater l’endoprothèse au-delà des limites suivantes:
Diamètre nominal de l'endoprothèse (mm) limite de dilatation (mm)
2,25-3,00 3,50
3,50 4,50
> Procédure de retrait :
1. Vérifier que le ballonnet est complètement dégonflé.
2. Tout en maintenant la position du guide et une pression négative sur le dispositif de gonflage, retirer le système d’insertion de l’endoprothèse.
Remarque: Lorsqu’une résistance inaccoutumée se fait sentir à un moment quelconque, que ce soit lors de la procédure d’acheminement vers le site de la lésion ou lors du retrait du système d’insertion avant implantation de l’endoprothèse, le système entier doit être retiré d’un seul tenant. Se reporter à la section Précautions à observer lors du retrait de l’endoprothèse/du système pour connaître les instructions spécifiques de retrait du système d’insertion.
3. Répéter l’angiographie pour évaluer la zone d’implantation. Si l’expansion n’est pas satisfaisante, réinsérer le cathéter d’insertion d’origine ou un autre cathéter à ballonnet de diamètre approprié afin d’obtenir un bon contact entre l’endoprothèse et la paroi vasculaire.
Le diamètre interne final de l’endoprothèse doit correspondre à celui du vaisseau de référence. S’assurer que l’endoprothèse est suffisamment déployée.
>Protocole antiplaquettaire :
L’utilisation d’aspirine associée au clopidogrel ou à la ticlopidine est appelée « double thérapie antiplaquettaire ». La durée optimale de la double thérapie antiplaquettaire, particulièrement avec le clopidogrel, est inconnue et une thrombose sous DES peut toujours survenir en dépit de la poursuite du
traitement. Les données de plusieurs études suggèrent qu’une administration du clopidogrel, plus longue que celle recommandée après l’implantation dans des essais fondamentaux sur les stents libérant des médicaments, pourrait être bénéfique. Se fondant sur l’opinion de consensus, les directives recommandent l’administration aux patients d’aspirine sur une durée indéfinie, avec un minimum de 6 mois de clopidogrel, prolongé à 12 mois chez les patients qui ne présentent pas un risque important d’hémorragie (réf. : les Directives PCI de l’American College of Cardiology (ACC) / American Heart Association (AHA) / Society of Cardiovascular Angiographic Interventions (SCAI) et de la Société européenne de Cardiologie (ESC)1,2,3).
Pour les patients traités pour un infarctus aigu du myocarde, une thérapie de 12 mois de clopidogrel est recommandée.
Il est très important que le patient se conforme aux recommandations sur la prise de produits antiplaquettaires après l’intervention. Interrompre précocement la prise de médicaments antiplaquettaires pourrait entraîner une augmentation du risque de thrombose, d’infarctus du myocarde ou de décès. Avant une intervention coronarienne percutanée (ICP), si on prévoit une intervention chirurgicale ou dentaire exigeant l’interruption du traitement antiplaquettaire, le cardiologue procédant à l’intervention et le patient doivent soigneusement déterminer si la pose d’une endoprothèse à élution médicamenteuse et le traitement antiplaquettaire recommandé qui lui est associé sont le choix de traitement ICP approprié. Après une ICP, si des interventions chirurgicale ou dentaire étaient recommandées, nécessitant l’interruption du traitement antiplaquettaire, les risques et les inconvénients de la procédure doivent être soigneusement pesés par rapport au risque potentiel associé à l’interruption précoce du traitement antiplaquettaire.
|
| 6.2 |
Indications (destination marquage CE) : |
| L’endoprothèse coronaire à libération de sirolimus CYPHER SELECT® + est indiquée pour élargir le diamètre luminal coronaire chez les :
- Patients atteints d’une maladie ischémique symptomatique imputable à des lésions discrètes de novo et des resténoses au site de l’endoprothèse (longueur = 30 mm) dans des artères coronaires natives, avec un diamètre vasculaire de référence de 2,25 mm à 4,00 mm ;
- Patients subissant une intervention coronaire percutanée primaire à la suite d’un infarctus aigu du myocarde, avec élévation du segment ST, dû à des lésions de novo (longueur = 30 mm) au niveau d’une artère coronaire native, avec un diamètre de vaisseau de référence de 2,25 à 4,00 mm ;
- Les patients souffrant de coronaropathie, avec un rétrécissement de 50 % ou plus de la lumière d’au moins deux artères coronaires natives. Ces artères doivent être = 2,25 mm et = 4 mm de diamètre et adjacentes au site de la sténose ;
- Patients atteints d’une cardiopathie ischémique symptomatique et de diabète, présentant des lésions discrètes (longueur = 30 mm), nouvelles ou de resténose au niveau du stent, des artères coronaires naturelles avec un diamètre vasculaire de référence de 2,25 à 4,00 mm ;
- Patients présentant une cardiopathie ischémique symptomatique due à une occlusion chronique totale des artères coronaires naturelles avec un diamètre vasculaire de référence de 2,25 à 4,00 mm.
Chez les patients présentant une occlusion chronique totale, on a démontré que le stent à libération de sirolimus CYPHER® réduit de manière significative la resténose binaire, la nécessité de procéder à une revascularisation de la lésion cible et la perte tardive contrôlée par angiographie, et ce jusqu’à
12 mois après implantation par comparaison avec un stent métallique nu.
Il a été montré que l’endoprothèse coronaire à libération de sirolimus CYPHER® réduit significativement les resténoses binaires, la revascularisation répétée des lésions cibles et la perte angiographique tardive à six mois, comparativement à une endoprothèse non enduite. Il a été également montré que
l’endoprothèse CYPHER® réduit de façon significative la resténose binaire et la perte tardive à 8 mois ainsi que la revascularisation de la lésion cible à 12 mois chez les patients ayant présenté un infarctus aigu du myocarde.
Chez les patients souffrant de coronaropathie, on a démontré que le traitement par stent à libération de sirolimus CYPHER® réduit de manière significative les complications majeures cardiaques ou cérébrovasculaires (décès, accident vasculaire, infarctus du myocarde, pontage aortocoronarien
du vaisseau cible et revascularisation du vaisseau cible) et les taux de réintervention à 3 ans par comparaison au traitement avec un stent non enduit, et peut avoir des résultats comparables au pontage chez certains patients.
Chez les patients souffrant de diabète, on a démontré que le stent à libération de sirolimus CYPHER® réduit de manière significative la resténose binaire, la nécessité de procéder à une revascularisation de la lésion cible et la perte tardive contrôlée par angiographie, et ce jusqu’à 24 mois après implantation par comparaison avec un stent métallique nu.
|
| 6.3 |
Précautions d'emploi : |
| L’utilisation de ce dispositif est associée à un risque de thrombose subaiguë, de complications vasculaires et/ou de troubles hémorragiques.
Le dispositif ne doit pas être utilisé chez les patients présentant une hypersensibilité connue au sirolimus ou à l’acier inoxydable 316L, aux polyméthacrylates ou aux copolymères à base de polyoléfines. Le dispositif doit être manipulé sous observation fluoroscopique de haute qualité. Ne faire avancer ou reculer le cathéter que lorsque que le ballonnet est complètement dégonflé par aspiration. Lorsqu’une résistance se fait sentir lors de la manipulation, il est impératif d’en déterminer la cause avant de continuer.
Ne jamais tenter de redresser un hypotube tordu. Le redressement d’une tige en métal tordue peut conduire à sa rupture.
La pression du ballonnet ne doit pas dépasser la pression d’éclatement nominale. La pression d’éclatement nominale est calculée sur la base des résultats d’essais in vitro. Au moins 99,9 % des ballonnets résistent à la pression d’éclatement nominale et aux pressions inférieures (avec un niveau de confiance de 95 %). Pour éviter toute surpression, l’utilisation d’un manomètre est recommandée.
Utiliser le dispositif avant la date de péremption indiquée sur l’emballage (mention « Utiliser avant le »).
L’endoprothèse doit être mise en place dans des hôpitaux disposant de l’équipement et du personnel nécessaires pour procéder d’urgence à un pontage de l’artère coronaire par greffe.
Un blocage ultérieur de l’endoprothèse peut nécessiter une nouvelle dilatation du segment artériel la contenant. L’évolution à long terme après un nouvelle dilatation d’une endoprothèse endothélialisée est mal caractérisée.
Le raccourcissement nominal maximal de l’endoprothèse est de 1 mm pour les endoprothèses de 3,50 mm de diamètre ou moins.
Afin d’éviter une éventuelle corrosion électrolytique, ne pas implanter d’endoprothèses constituées de matériaux différents en tandem en cas de risque de chevauchement ou de contact.
Ne pas utiliser avec un milieu de contraste Ethiodol ou Lipiodol.
Ne pas exposer le système d’insertion à des solvants organiques tels que l’alcool, ni à des détergents.
Lors de l’insertion du système dans la valve hémostatique, prendre soin d’éviter toute torsion.
Lors du retrait du système d’insertion, maintenir une compresse imprégnée de sérum physiologique autour de la tige exposée du cathéter et tirer sur le cathéter à travers la compresse afin d’éliminer
l’excès de milieu de contraste.
L’étui en aluminium constitue la barrière stérile. Seul le contenu de l’étui en aluminium doit par conséquent être considéré comme stérile.
L’étui en aluminium a pour but de prolonger la durée de conservation de l’endoprothèse coronaire à libération de sirolimus CYPHER SELECT TM +. Ne sortir le contenu de l’étui en aluminium que juste avant l’utilisation.
> Interactions médicamenteuses :
Bien qu’aucune donnée clinique spécifique ne soit disponible, les médicaments tels que le tacrolimus, qui agissent par le biais de la même protéine de liaison (FKBP), peuvent réduire l’efficacité du sirolimus. Aucune étude d’interaction médicamenteuse n’a été conduite. Le sirolimus est métabolisé par le CYP3A4. Les inhibiteurs puissants du CYP3A4 (par ex., le kétoconazol) peuvent entraîner une augmentation de l’exposition au sirolimus, jusqu’à un niveau associé à des effets systémiques, en particulier si plusieurs endoprothèses sont déployées. L’exposition systémique au sirolimus doit également être prise en considération si le patient reçoit en parallèle un traitement immunosuppresseur systémique.
|
| 6.4 |
Contre indications (absolues et relatives) : |
| L’implantation d’une endoprothèse coronaire est généralement contre-indiquée dans les cas suivants:
- Patients chez qui un traitement antiplaquettaire et/ou anticoagulant est contre-indiqué.
- Patients présentant une lésion jugée incompatible avec le gonflage complet d’un ballonnet d’angioplastie.
- Patients transplantés
|
| 7. Informations complémentaires sur le produit |
| |
Informations complémentaires : |
| |
| 8. Documents annexés au dossier DM |
| |
|
| 9. Images (photos, étiquettes...) |
| |
|
Télécharger PDF Creator pour imprimer au format PDF
|