|
Votre recherche : Electrodes chirurgicales de neurostimulation RESUME II, RESUME TL et ONPOINT
Dossier d'information Euro-Pharmat
Dispositif médical

|
Dossier d'information Euro-Pharmat
Dispositif médical
|
| Electrodes chirurgicales de neurostimulation RESUME II, RESUME TL et ONPOINT |
| |
|
|
Date de mise à jour : |
08/08/2013 14:17:00
|
| 1. Renseignements administratifs concernant l'entreprise |
| 1.1 |
Nom : |
MEDTRONIC FRANCE SAS |
| 1.2 |
Adresse : |
27 Quai Alphonse Le Gallo
CS 30001
92513 BOULOGNE BILLANCOURT CEDEX
|
| Tél. : |
01 55 38 17 00 |
| Fax : |
01 55 38 18 91 |
| e-mail : |
antoine.audry@medtronic.com
|
| Site : |
http://www.medtronic.fr
|
| 1.3 |
Correspondant matériovigilance : |
JEGOU Claire |
| Tél. : |
01 55 38 18 74 |
| Fax : |
01 55 38 18 91 |
| e-mail : |
claire.jegou@medtronic.com
|
| 2. Informations sur dispositif ou équipement |
| 2.1 |
Dénomination commune selon la nomenclature Euro-Pharmat : |
ELECTRODE NEUROSTIMULATION DOULEUR |
| 2.2 |
Dénomination commerciale : |
Electrodes chirurgicales de neurostimulation RESUME II, RESUME TL et ONPOINT |
| 2.3 |
Code Nomenclature : |
code GMDN : 44040 |
| Code CLADIMED : |
|
| 2.4 |
Code LPPR* (Ex TIPS) si applicable :
* Liste des produits et prestations remboursables inscrits sur la liste prévue à l'article L165-1
|
3420056 |
| 2.5 |
Classe du DM : |
DMIA |
| Directive de l'UE applicable : |
90/385/CEE |
| N° Organisme notifié : |
0123 |
| Première mise sur le marché dans l'UE : |
01/01/1993 |
| Fabricant : |
Medtronic Inc |
| 2.6 |
Descriptif du dispositif : |
|
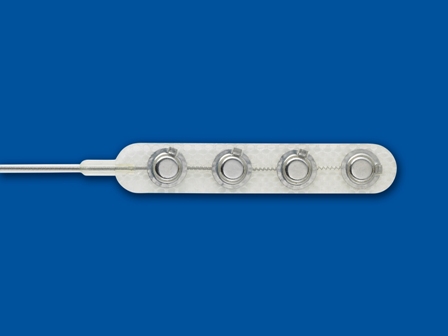
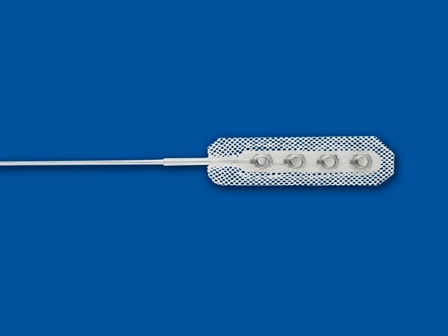
| Les électrodes Modèles 3587A Resume II, 3986A Resume TL et 3987A On-Point de Medtronic font partie du système de neurostimulation médullaire pour le soulagement de la douleur. Ce sont de électrodes quadripolaires (4 plots) de type chirurgicales, implantées via une laminectomie. |
| 2.7 |
Références catalogue : |
|
Référence :
cf pièces jointes
Descriptif :
Conditionnement :
UCD Unité de commande : 1 SACHET(S) PELABLE(S)
CDT Conditionnement : 1 SACHET(S) PELABLE(S)
QML Quantité mimimale de livraison : 1 SACHET(S) PELABLE(S)
Constitution :
-contenu de l'emballage : Électrode et connecteur
¦ Extension percutanée
¦ Manchon de fixation autobloquant
¦ Manchons de fixation en silicone
¦ Capuchon de protection du connecteur
¦ Élévateur de passage (3587A, 3982A, 3986A)
¦ Électrode fantôme (3587A, 3982A, 3986A)
¦ Câble du stimulateur test
¦ Kit de tunnellisation : tunnellisateur, embouts de tunnellisation (étroit),
tube guide
¦ Tournevis dynamométrique
¦ Documentation
¦ Carte de garantie (États-Unis uniquement)
¦ Carte d'enregistrement (États-Unis uniquement)
| |
|
| 2.8 |
Composition du dispositif et accessoires : |
| Principaux composants et matériaux :
|
ELECTRODE
- PLATINIUM IRIDIUM
ISOLATION
- SILICONE
TUNNELISATEUR
- ACIER INOXYDABLE
ISOLATION
- POLYMERE
|
| Substances actives : |
|
|
|
Pour les composants suceptibles d'entrer en contact avec le patient et/ou les produits administrés, précisions complémentaires
|
| Latex : |
Non |
| Phtalates : |
Non |
| Origine animale ou biologique : |
Non |
| Dispositifs et accessoires associés (consommables captifs notamment) : |
| Extension percutanée temporaire (connection coaxiale) réf 3550.05
Câble test avec boîtier connecteur réf 3550.31
stimulateur test réf 37022 |
| 2.9 |
Domaines et indications (selon nomenclature Euro-Pharmat) : |
| Domaines : |
|
|
| Indications (Informations complémentaires au paragraphe 6) : |
|
NEUROSTIMULATION
|
| 4. Conditions de conservation |
| |
Conditions normales de conservation et de stockage : |
| se reporter au manuel d'utilisation |
| Précautions particulières : |
| se reporter au manuel d'utilisation |
| Durée de validité du produit : |
| 4 ans |
| Présence d'indicateurs de température (s'il y a lieu) : |
| non |
| 5. Sécurité d'utilisation |
| 5.1 |
Sécurité technique : |
| se reporter au manuel d'utilisation |
| 5.2 |
Sécurité biologique (s'il y a lieu) : |
| Dispositif ne comportant pas d'élément d'origine animale ou humaine |
| 6. Conseils d'utilisation |
| 6.1 |
Mode d'emploi : |
| se référer au manuel d'utilisation |
| 6.2 |
Indications (destination marquage CE) : |
| Les systèmes de stimulation médullaire de Medtronic sont indiqués dans le traitement des douleurs chroniques rebelles du tronc et/ou des membres, des maladies vasculaires périphériques ainsi que des angors réfractaires, telles que:
Douleurs chroniques neuropathiques irréductibles, après échec des autres
moyens thérapeutiques, secondaires à :
des radiculalgies chroniques (sciatalgies, cruralgies, cervico-brachialgies),
une lésion nerveuse périphérique, post-traumatique ou post-chirurgicale,
une amputation (algo-hallucinose),
un syndrome régional douloureux complexe (dystrophies sympathiques
réflexe, causalgies périphériques).
Douleurs ischémiques périphériques type artérite de stade III, IV |
| 6.3 |
Précautions d'emploi : |
| se reporter au manuel d'utilisation |
| 6.4 |
Contre indications (absolues et relatives) : |
| se reporter au manuel d'utilisation |
| 7. Informations complémentaires sur le produit |
| |
Informations complémentaires : |
| COMPATIBILITE AVEC LES STIMULATEURS:
Restore, Synergy et PrimeAdvanced |
| 8. Documents annexés au dossier DM |
| |
|
| 9. Images (photos, étiquettes...) |
| |

|
Télécharger PDF Creator pour imprimer au format PDF
|