|
Votre recherche : Liquiband Fix8 Open
Dossier d'information Euro-Pharmat
Dispositif médical

|
Dossier d'information Euro-Pharmat
Dispositif médical
|
| Liquiband Fix8 Open |
| 4. Conditions de conservation |
| |
Conditions normales de conservation et de stockage : |
| Le système doit toujours être conservé dans son emballage d’origine.
Le conserver à une température comprise entre 5 °C (41 °F) et 25 °C (77 °F).
Ne pas utiliser le système après la date de péremption indiquée sur l’emballage. |
| Précautions particulières : |
| |
| Durée de validité du produit : |
| |
| Présence d'indicateurs de température (s'il y a lieu) : |
| |
| 5. Sécurité d'utilisation |
| 5.1 |
Sécurité technique : |
| |
| 5.2 |
Sécurité biologique (s'il y a lieu) : |
| |
| 6. Conseils d'utilisation |
| 6.1 |
Mode d'emploi : |
| |
| 6.2 |
Indications (destination marquage CE) : |
| Fixation de prothèse herniaire : Comme avec la plupart des dispositifs implantés, les effets indésirables associés à
l’utilisation de ce système peuvent comprendre une irritation locale transitoire au niveau du site d’implantation et
une réaction inflammatoire transitoire à un corps étranger.
Fermeture de plaie topique : L’utilisation clinique d’adhésifs cutanés topiques à base de cyanoacrylate peut
entraîner les effets indésirables suivants : déhiscence de la plaie ; infection ; inflammation aiguë, y compris
érythème, œdème et drainage ; collage de tissus non souhaités comme l’œil ; gêne thermique pendant la
polymérisation ; réaction allergique ; réaction à un corps étranger et non cicatrisation chronique d’une plaie.
Voir marquage CE
|
| 6.3 |
Précautions d'emploi : |
| |
| 6.4 |
Contre indications (absolues et relatives) : |
| |
| 7. Informations complémentaires sur le produit |
| |
Informations complémentaires : |
| |
| 8. Documents annexés au dossier DM |
| |
|
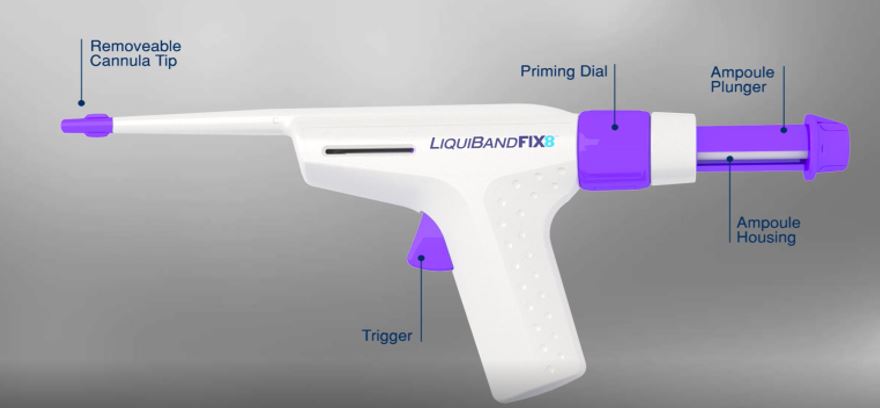
| 9. Images (photos, étiquettes...) |
| |
|
Télécharger PDF Creator pour imprimer au format PDF
|