|
Votre recherche : Système de remplacement de la valve tricuspide Edwards EVOQUE
Dossier d'information Euro-Pharmat
Dispositif médical

|
Dossier d'information Euro-Pharmat
Dispositif médical
|
| Système de remplacement de la valve tricuspide Edwards EVOQUE |
| |
|
|
Date de mise à jour : |
22/01/2025 11:58:52
|
| 1. Renseignements administratifs concernant l'entreprise |
| 1.1 |
Nom : |
EDWARDS LIFESCIENCES SAS |
| 1.2 |
Adresse : |
1 rue Arnold Schoenberg
78280 GUYANCOURT
|
| Tél. : |
|
| Fax : |
|
| e-mail : |
sara_delannay@edwards.com
|
| Site : |
http://www.edwards.com
|
| 1.3 |
Correspondant matériovigilance : |
Maite LLACER |
| Tél. : |
+34 96 305 37 14 |
| Fax : |
+33 1 30 05 29 64 |
| e-mail : |
complaints_INTL_SURG@edwards.com
|
| 2. Informations sur dispositif ou équipement |
| 2.1 |
Dénomination commune selon la nomenclature Euro-Pharmat : |
VALVE CARDIAQUE TRICUSPIDE PERCUTANEE |
| 2.2 |
Dénomination commerciale : |
Système de remplacement de la valve tricuspide Edwards EVOQUE |
| 2.3 |
Code Nomenclature : |
65121 / 58865 |
| Code CLADIMED : |
P070301030104 / P07038002 / C0602 |
| 2.4 |
Code LPPR* (Ex TIPS) si applicable :
* Liste des produits et prestations remboursables inscrits sur la liste prévue à l'article L165-1
|
N/A |
| 2.5 |
Classe du DM : |
III |
| Directive de l'UE applicable : |
MDR |
| N° Organisme notifié : |
0344 |
| Première mise sur le marché dans l'UE : |
27/10/2023 |
| Fabricant : |
EDWARDS LIFESCIENCES |
| 2.6 |
Descriptif du dispositif : |
|
| Le système de remplacement de la valve tricuspide Edwards EVOQUE est conçu pour remplacer la valve tricuspide native chez les patients présentant une régurgitation tricuspide symptomatique et grave sans avoir à recourir à une intervention à coeur ouvert classique.
Le système EVOQUE se compose de quatre éléments et inclut trois accessoires en option, comme décrit ci-dessous:
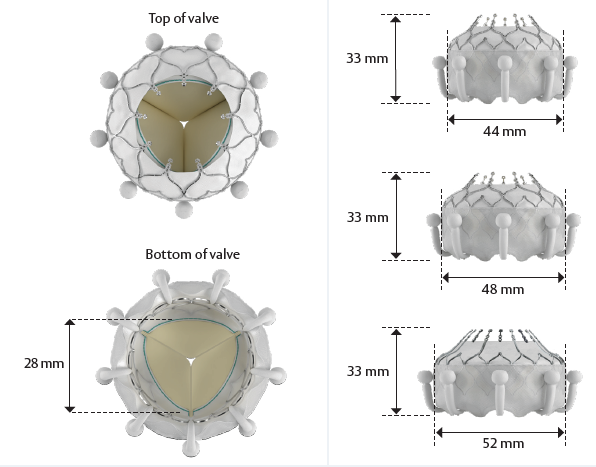
* La Valve Edwards EVOQUE : Elle est prévue pour être implantée en position tricuspide en remplacement de la chirurgie. La valve EVOQUE, qui comprend une valve à trois valvules en tissu péricardique bovin, une structure en nitinol et un manchon en tissu, est conditionnée et stérilisée au glutaraldéhyde au stade terminal.
Les tailles recommandées pour la valve sont basées sur la taille de l’anneau valvulaire natif, telle que mesurée par tomodensitométrie (TDM). Le choix de la taille de la valve doit également tenir compte des caractéristiques anatomiques du patient et des modalités d’imagerie.
* Le système de mise en place tricuspide Edwards EVOQUE : Il est conçu pour mettre en place la valve EVOQUE en position sertie via l’approche veineuse transfémorale. Le système de mise en place a un diamètre externe de 28 F. La poignée du système de mise en place comprend une molette de section flexible primaire, une molette de section flexible secondaire et une molette de profondeur afin de faciliter l’alignement et le positionnement de la valve EVOQUE dans la valve native. Elle comprend également une molette de capsule et une molette de libération pour contrôler le déploiement et la libération de la valve EVOQUE.
* Le kit de dilatateurs Edwards EVOQUE : Ces dilatateurs sont prévus pour dilater le site d’accès, ce qui facilite l’insertion du système de mise en place. Tous les dilatateurs, à revêtement hydrophile de 24 F, 28 F et 33 F de diamètre, intègrent un fil-guide de 0,89 mm (0,035 po) et sont fuselés pour réduire au maximum le traumatisme au niveau du site d’accès.
*Système de chargement Edwards EVOQUE : Il intègre plusieurs composants, facilite le chargement et la fixation de la valve EVOQUE sur le système de mise en place. Il aide également à sertir la valve EVOQUE au diamètre approprié, ce qui permet de faire progresser la capsule externe sur la valve EVOQUE.
* Ensemble d’accessoires 1 pour système Edwards EVOQUE : stabilisateur (modèle 9850SB), base et plateau
Le stabilisateur à usage unique, avec la base et le plateau à usage unique sont conçus pour maintenir le système de mise en place à un angle approprié lors de l’approche par la veine transfémorale et pour
ajuster précisément sa position au cours de la procédure d’implantation.
La base est réglable en hauteur pour s’adapter aux extrémités inférieures du patient. Elle offre une base stable pour le stabilisateur.Le plateau fournit une surface stable et plate pour la base sur la table d’opération.
* Ensemble d’accessoires 2 pour système Edwards EVOQUE : stabilisateur (modèle 9850SZ), et rail, plateforme et plateau réutilisables.
Les accessoires réutilisables compatibles avec le système EVOQUE incluent le rail, la plateforme et le plateau réutilisables. Le rail réutilisable est un rail stable stérilisable qui fournit une surface pour fixer le
stabilisateur compatible à la plateforme réutilisable. La plateforme réutilisable permet de positionner et de stabiliser les systèmes de mise en place pour le remplacement de la valve transcathéter Edwards,
en fournissant la possibilité d’ajuster la hauteur des jambes du patient et une plateforme stable.
Le plateau réutilisable est placé sous la plateforme réutilisable de manière à fournir une surface stable et plate pendant l’utilisation. Le stabilisateur à usage unique sert à faciliter le positionnement et la stabilisation du système EVOQUE lors des procédures d’implantation.
|
| 2.7 |
Références catalogue : |
|
Référence :
9850EV44
Descriptif :
Valve Edwards EVOQUE taille 44mm
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 CARTON(S)
QML Quantité mimimale de livraison : 1 UNITE(S)
Caractéristique(s) :
|
Référence :
9850EV48
Descriptif :
Valve Edwards EVOQUE taille 48mm
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 CARTON(S)
QML Quantité mimimale de livraison : 1 UNITE(S)
Caractéristique(s) :
|
|
Référence :
9850EV52
Descriptif :
Valve Edwards EVOQUE taille 52mm
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 CARTON(S)
QML Quantité mimimale de livraison : 1 UNITE(S)
Caractéristique(s) :
|
Référence :
9850EV56
Descriptif :
Valve Edwards EVOQUE taille 56mm
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 CARTON(S)
QML Quantité mimimale de livraison : 1 UNITE(S)
Caractéristique(s) :
|
|
| 2.8 |
Composition du dispositif et accessoires : |
| Principaux composants et matériaux :
|
|
Non renseigné
|
| Substances actives : |
|
|
|
Pour les composants suceptibles d'entrer en contact avec le patient et/ou les produits administrés, précisions complémentaires
|
| Latex : |
Non |
| Phtalates : |
Non |
| Origine animale ou biologique : |
Oui |
| Dispositifs et accessoires associés (consommables captifs notamment) : |
| Ensemble d’accessoires 1:
*Stabilisateur Edwards EVOQUE 9850SB
*Base du stabilisateur Edwards EVOQUE 9850BA
*Plateau du stabilisateur Edwards EVOQUE 9850PT
Ensemble d’accessoires 2:
*Stabilisateur Edwards EVOQUE 9850SZ
*Rail réutilisable Edwards 10500RL
*Plateforme réutilisable Edwards 10000UP
*Plateau réutilisable Edwards 10000PT |
| 2.9 |
Domaines et indications (selon nomenclature Euro-Pharmat) : |
| Domaines : |
|
|
| Indications (Informations complémentaires au paragraphe 6) : |
|
|
| 4. Conditions de conservation |
| |
Conditions normales de conservation et de stockage : |
| La valve EVOQUE doit être entreposée à une température comprise entre 10 °C et 25 °C (50 °F et 77 °F).
Il est recommandé de procéder à une inspection et à une rotation des stocks à intervalles réguliers afin que la valve EVOQUE avec la date d’expiration la plus proche soit utilisée en premier.
Le système de mise en place, le kit de dilatateurs, le système de chargement, le stabilisateur, la base et le plateau et doivent être conservés dans un endroit frais et sec, exempt de contamination. |
| Précautions particulières : |
| |
| Durée de validité du produit : |
| |
| Présence d'indicateurs de température (s'il y a lieu) : |
| |
| 5. Sécurité d'utilisation |
| 5.1 |
Sécurité technique : |
| |
| 5.2 |
Sécurité biologique (s'il y a lieu) : |
| |
| 6. Conseils d'utilisation |
| 6.1 |
Mode d'emploi : |
| |
| 6.2 |
Indications (destination marquage CE) : |
| Le système de remplacement de la valve tricuspide EVOQUE permet de réduire la régurgitation tricuspidienne (TR) chez les patients qui restent symptomatiques sous traitement médical et chez qui aucune autre option de traitement chirurgical ou transcathéter n’existe selon l’avis de l’équipe cardiaque. |
| 6.3 |
Précautions d'emploi : |
| |
| 6.4 |
Contre indications (absolues et relatives) : |
| |
| 7. Informations complémentaires sur le produit |
| |
Informations complémentaires : |
| |
| 8. Documents annexés au dossier DM |
| |
|
| 9. Images (photos, étiquettes...) |
| |









|
Télécharger PDF Creator pour imprimer au format PDF
|