|
Votre recherche : Système Edwards SAPIEN 3 Valve cardiaque transcathéter avec système de mise en place Edwards Commander
Dossier d'information Euro-Pharmat
Dispositif médical

|
Dossier d'information Euro-Pharmat
Dispositif médical
|
| Système Edwards SAPIEN 3 Valve cardiaque transcathéter avec système de mise en place Edwards Commander |
| |
|
|
Date de mise à jour : |
29/09/2025 10:19:02
|
| 1. Renseignements administratifs concernant l'entreprise |
| 1.1 |
Nom : |
EDWARDS LIFESCIENCES SAS |
| 1.2 |
Adresse : |
1 rue Arnold Schoenberg
78280 GUYANCOURT
|
| Tél. : |
|
| Fax : |
|
| e-mail : |
sara_delannay@edwards.com
|
| Site : |
http://www.edwards.com
|
| 1.3 |
Correspondant matériovigilance : |
Maite LLACER |
| Tél. : |
+34 96 305 37 14 |
| Fax : |
+33 1 30 05 29 64 |
| e-mail : |
complaints_INTL_SURG@edwards.com
|
| 2. Informations sur dispositif ou équipement |
| 2.1 |
Dénomination commune selon la nomenclature Euro-Pharmat : |
VALVE CARDIAQUE BIOLOGIQUE PERICARDIQUE |
| 2.2 |
Dénomination commerciale : |
Système Edwards SAPIEN 3 Valve cardiaque transcathéter avec système de mise en place Edwards Commander |
| 2.3 |
Code Nomenclature : |
60245 , 60246 , 60247 |
| Code CLADIMED : |
P070301030201 , P070301030202 , P070301030203 |
| 2.4 |
Code LPPR* (Ex TIPS) si applicable :
* Liste des produits et prestations remboursables inscrits sur la liste prévue à l'article L165-1
|
3299070 |
| 2.5 |
Classe du DM : |
III |
| Directive de l'UE applicable : |
MDR |
| N° Organisme notifié : |
0344 |
| Première mise sur le marché dans l'UE : |
30/09/2022 |
| Fabricant : |
EDWARDS LIFESCIENCES LLC |
| 2.6 |
Descriptif du dispositif : |
|
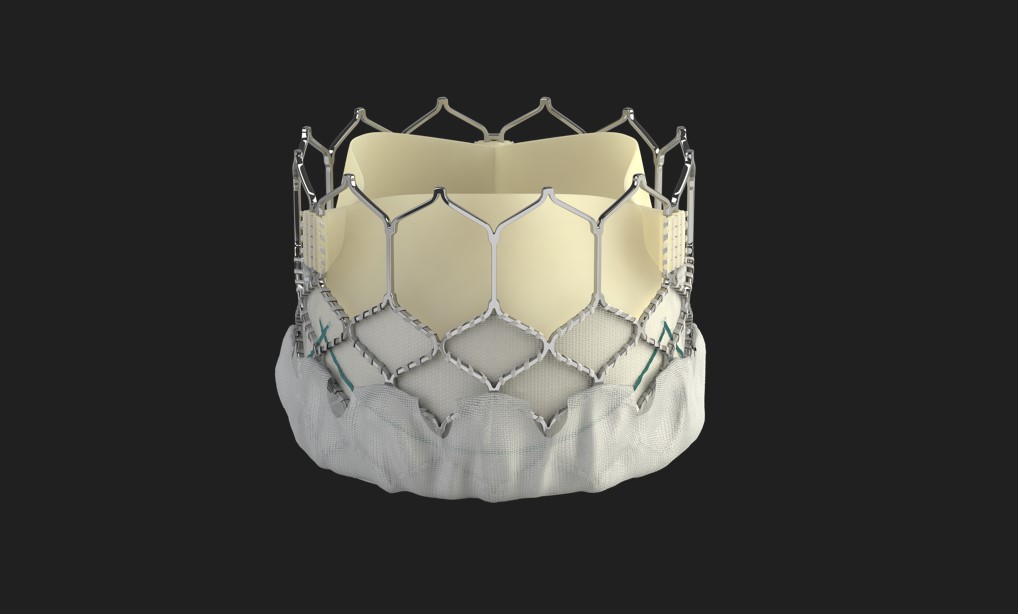
| *Système de valve cardiaque transcathéter Edwards SAPIEN 3:
Le système de valve cardiaque transcathéter Edwards SAPIEN 3 (THV) se compose de la valve cardiaque transcathéter Edwards SAPIEN 3 et des systèmes de mise en place.
*Valve cardiaque transcathéter Edwards SAPIEN 3:
La valve cardiaque transcathéter Edwards SAPIEN 3 (THV) se compose d’une structure radio-opaque en chrome-cobalt déployable par ballonnet, d’une valve à trois valvules en tissu péricardique bovin, et de manchons en tissu interne et externe en polyéthylène téréphtalate (PET).
Les valvules sont traitées conformément au processus Carpentier-Edwards ThermaFix.
La THV est conçue pour être implantée dans un anneau natif, dont la plage de tailles proposées est associée à la surface tridimensionnelle de l’anneau aortique mesurée à l’anneau basal au cours de la systole.
*Système de mise en place Edwards COMMANDER :
Le système de mise en place Edwards COMMANDER facilite la mise en place de la bioprothèse.
Il se compose d’un cathéter flexible pour faciliter l’alignement de la valve par rapport au ballonnet, le suivi et le positionnement de la THV. Le système de mise en place inclut un embout fuselé pour faciliter le franchissement de la valve. La poignée comporte une molette de flexibilité pour contrôler la flexion du cathéter flexible, un mécanisme de verrouillage du ballonnet et une molette de réglage fin pour faciliter l’alignement de la valve et son positionnement dans l’emplacement cible.Un stylet est inclus dans la lumière du fil-guide du système de mise en place. Le cathéter à ballonnet est muni de repères d’alignement de la valve radio-opaques qui définissent la longueur utile du ballonnet. Un repère central radio-opaque est situé dans le ballonnet pour faciliter le positionnement de la valve. Un repère triple radio-opaque en amont du ballonnet indique la position du cathéter flexible pendant le déploiement.
*Gaine Edwards :
Se reporter au mode d’emploi de la gaine pour la description du dispositif.
*Accessoire de sertissage Qualcrimp :
L’accessoire de sertissage Qualcrimp s’utilise lors du sertissage de la THV.
*Chargeur :
Le chargeur est utilisé pendant l’insertion du système de mise en place dans la gaine.
*Sertisseur Edwards et butée de sertissage :
Le sertisseur Edwards réduit le diamètre de la valve pour la monter sur le système de mise en place. Le sertisseur comporte un boîtier et un mécanisme de compression fermé à l’aide d’une poignée située sur le boîtier.
Une butée de sertissage à 2 pièces est utilisée pour sertir la valve au diamètre voulu.
*Dispositif de gonflage:
Un dispositif de gonflage avec mécanisme de verrouillage s’utilise pendant le déploiement de la valve.
*Informations qualitatives et quantitatives:
Oxyde d’éthylène (OE)
• Valves : pas de trace d’OE (stérilisées dans une solution de glutaraldéhyde).
• Système de mise en place et accessoires : stérilisés à l’oxyde d’éthylène gazeux
o Esheath : quantité résiduelle d’OE après 3 jours = ¾ de la limite autorisée.
o Sertisseur : quantité résiduelle d’OE inférieure à 2,4 mg.
Cobalt
• Plage de masse du modèle entre 131 et 427 mg. |
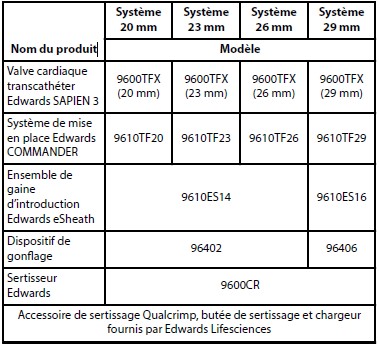
| 2.7 |
Références catalogue : |
|
Référence :
S3TF320
Descriptif :
Système Edwards SAPIEN 3 Ultra avec le système commander, valve taille 20mm.
Conditionnement :
UCD Unité de commande : 1 BLISTER(S) PELABLE(S)
CDT Conditionnement : 1 CARTON(S)
QML Quantité mimimale de livraison : 1 UNITE(S)
Caractéristique(s) :
|
Référence :
S3TF323
Descriptif :
Système Edwards SAPIEN 3 Ultra avec le système commander, valve taille 23mm
Conditionnement :
UCD Unité de commande : 1 BLISTER(S) PELABLE(S)
CDT Conditionnement : 1 CARTON(S)
QML Quantité mimimale de livraison : 1 UNITE(S)
Caractéristique(s) :
|
|
Référence :
S3TF326
Descriptif :
Système Edwards SAPIEN 3 Ultra avec le système commander, valve taille 26 mm.
Conditionnement :
UCD Unité de commande : 1 BLISTER(S) PELABLE(S)
CDT Conditionnement : 1 CARTON(S)
QML Quantité mimimale de livraison : 1 UNITE(S)
Caractéristique(s) :
|
Référence :
S3TF329
Descriptif :
Système Edwards SAPIEN 3 Ultra avec le système commander, valve taille 29 mm.
Conditionnement :
UCD Unité de commande : 1 BLISTER(S) PELABLE(S)
CDT Conditionnement : 1 CARTON(S)
QML Quantité mimimale de livraison : 1 UNITE(S)
Caractéristique(s) :
|
|
| 2.8 |
Composition du dispositif et accessoires : |
| Principaux composants et matériaux :
|
VALVE
- PERICARDE BOVIN
VALVE
- ALLIAGE CHROME COBALT
MANCHON
- POLYETHYLENE TEREPHTALATE
|
| Substances actives : |
|
|
|
Pour les composants suceptibles d'entrer en contact avec le patient et/ou les produits administrés, précisions complémentaires
|
| Latex : |
Non |
| Phtalates : |
Non |
| Origine animale ou biologique : |
Oui |
| Dispositifs et accessoires associés (consommables captifs notamment) : |
| |
| 2.9 |
Domaines et indications (selon nomenclature Euro-Pharmat) : |
| Domaines : |
|
|
| Indications (Informations complémentaires au paragraphe 6) : |
|
|
| 4. Conditions de conservation |
| |
Conditions normales de conservation et de stockage : |
| *Mode de sterilisation :
la valve est fournie stérilisée dans une solution de glutaraldéhyde.
Le système de mise en place et les accessoires sont fournis stérilisés à l'oxyde d'éthylène gazeux.
*condition de conservation :
La THV doit être entreposée à une température comprise entre 10 °C et25 °C (50 °F et 77 °F).
Chaque flacon est expédié dans un boîtier contenant un indicateur de température destiné à détecter une exposition éventuelle de la THV à des températures extrêmes.
Le système de mise en place et les accessoires doivent être conservés dans un endroit frais et sec. |
| Précautions particulières : |
| se référer à l'instruction d'utilisation ,page 3. |
| Durée de validité du produit : |
| |
| Présence d'indicateurs de température (s'il y a lieu) : |
| |
| 5. Sécurité d'utilisation |
| 5.1 |
Sécurité technique : |
| |
| 5.2 |
Sécurité biologique (s'il y a lieu) : |
| |
| 6. Conseils d'utilisation |
| 6.1 |
Mode d'emploi : |
| |
| 6.2 |
Indications (destination marquage CE) : |
| Le système de valve cardiaque transcathéter Edwards SAPIEN 3 est indiqué chez les patients atteints de maladies cardiaques dues à une sténose aortique calcifiée native à l’un ou tous les niveaux de risque pour une chirurgie à cœur ouvert.
Le système de valve cardiaque transcathéter Edwards SAPIEN 3 est indiqué chez les patients atteints de maladies cardiaques symptomatiques dues à une bioprothèse aortique transcathéter ou à une bioprothèse valvulaire aortique ou mitrale chirurgicale défaillante (sténosée, insuffisante ou les deux), et qui sont considérés par l’équipe de cardiologie, notamment le chirurgien cardiaque,comme présentant un risque élevé ou supérieur pour une intervention chirurgicale ouverte (c.-à-d., un risque prévu demortalité liée à la chirurgie = 8 % à 30 jours, basé sur le score de risque de la Society of Thoracic Surgeons [STS] et sur d’autres comorbidités cliniques non mesurées par le calculateur de risque dela STS). |
| 6.3 |
Précautions d'emploi : |
| |
| 6.4 |
Contre indications (absolues et relatives) : |
| |
| 7. Informations complémentaires sur le produit |
| |
Informations complémentaires : |
| |
| 8. Documents annexés au dossier DM |
| |
|
| 9. Images (photos, étiquettes...) |
| |

|
Télécharger PDF Creator pour imprimer au format PDF
|