|
Votre recherche : Neurostimulateur médullaire rechargeable RESTORE
Dossier d'information Euro-Pharmat
Dispositif médical

|
Dossier d'information Euro-Pharmat
Dispositif médical
|
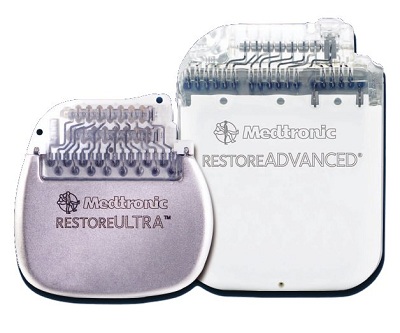
| Neurostimulateur médullaire rechargeable RESTORE |
| |
|
|
Date de mise à jour : |
06/04/2023 16:02:45
|
| 1. Renseignements administratifs concernant l'entreprise |
| 1.1 |
Nom : |
MEDTRONIC FRANCE SAS |
| 1.2 |
Adresse : |
27 Quai Alphonse Le Gallo
CS 30001
92513 BOULOGNE BILLANCOURT CEDEX
|
| Tél. : |
01 55 38 17 00 |
| Fax : |
01 55 38 18 91 |
| e-mail : |
antoine.audry@medtronic.com
|
| Site : |
http://www.medtronic.fr
|
| 1.3 |
Correspondant matériovigilance : |
JEGOU Claire |
| Tél. : |
01 55 38 18 74 |
| Fax : |
01 55 38 18 91 |
| e-mail : |
claire.jegou@medtronic.com
|
| 4. Conditions de conservation |
| |
Conditions normales de conservation et de stockage : |
| se reporter au manuel d'utilisation |
| Précautions particulières : |
| se reporter au manuel d'utilisation |
| Durée de validité du produit : |
| inférieur à 12mois |
| Présence d'indicateurs de température (s'il y a lieu) : |
| non |
| 5. Sécurité d'utilisation |
| 5.1 |
Sécurité technique : |
| se reporter au manuel d'utilisation |
| 5.2 |
Sécurité biologique (s'il y a lieu) : |
| Dispositif ne comportant aucun élement d'origine animale ou humaine |
| 6. Conseils d'utilisation |
| 6.1 |
Mode d'emploi : |
| Se reporter au manuel d'utilisation |
| 6.2 |
Indications (destination marquage CE) : |
| indication (lppr) :
- Douleurs chroniques neuropathiques irréductibles, après échec des autres
moyens thérapeutiques, secondaires à :
· des radiculalgies chroniques (sciatalgies, cruralgies, cervico-brachialgies),
· une lésion nerveuse périphérique, post-traumatique ou post-chirurgicale,
· une amputation (algo-hallucinose),
· un syndrome régional douloureux complexe (dystrophies sympathiques
réflexe, causalgies périphériques).
- Douleurs ischémiques périphériques type artérite de stade III, IV |
| 6.3 |
Précautions d'emploi : |
| Se referer au manuel d'utilisation |
| 6.4 |
Contre indications (absolues et relatives) : |
| se reporter au manuel d'utilisation |
| 7. Informations complémentaires sur le produit |
| |
Informations complémentaires : |
| |
| 8. Documents annexés au dossier DM |
| |
|
| 9. Images (photos, étiquettes...) |
| |

|
Télécharger PDF Creator pour imprimer au format PDF
|