|
Votre recherche : Lumenis® PULSE™ 120H, laser chirurgical holmium
Dossier d'information Euro-Pharmat
Dispositif médical

|
Dossier d'information Euro-Pharmat
Dispositif médical
|
| Lumenis® PULSE™ 120H, laser chirurgical holmium |
| 2. Informations sur dispositif ou équipement |
| 2.1 |
Dénomination commune selon la nomenclature Euro-Pharmat : |
LASER |
| 2.2 |
Dénomination commerciale : |
Lumenis® PULSE™ 120H, laser chirurgical holmium |
| 2.3 |
Code Nomenclature : |
36170 |
| Code CLADIMED : |
|
| 2.4 |
Code LPPR* (Ex TIPS) si applicable :
* Liste des produits et prestations remboursables inscrits sur la liste prévue à l'article L165-1
|
|
| 2.5 |
Classe du DM : |
IIb |
| Directive de l'UE applicable : |
93/42/EEC |
| N° Organisme notifié : |
0483 |
| Première mise sur le marché dans l'UE : |
01/01/2013 |
| Fabricant : |
Lumenis Ltd. |
| 2.6 |
Descriptif du dispositif : |
|
| Le laser Holmium Lumenis Pulse 120H s'utilise en urologie, en orthopédie, en ORL, en gynécologie et en chirurgie générale. L'émission d'énergie laser Holmium par fibre est idéale pour une intervention chirurgicale mini-invasive.
Le laser Lumenis Pulse 120H comprend les principaux composants et caractéristiques suivants:
- Console laser
- Ecran de contrôle rotatif
- Interrupteur au pied à double pédale
- Pompe d'aspiration intégrée (en option)
- Bras de soutient de la fibre
- Technologie de Système d'identification de sécurité (Security Identification System, SIS)
- Faisceau de visée vert
L’appareil incorpore la fonctionnalité MOSES qui pourra être utilisée si une fibre compatible est connectée au système. |
| 2.7 |
Références catalogue : |
|
Référence :
GA-0008700
Descriptif :
Lumenis Pulse 120H, INT 1PH 32A?
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 UNITE(S)
Caractéristique(s) :
|
Référence :
GA-0006902
Descriptif :
Lumenis Pulse 120H, MOSES 2.0 (INT)
Conditionnement :
UCD Unité de commande : 1 BOITE(S)
CDT Conditionnement : 1 BOITE(S)
QML Quantité mimimale de livraison : 1 UNITE(S)
Caractéristique(s) :
|
|
| 2.8 |
Composition du dispositif et accessoires : |
| Principaux composants et matériaux :
|
|
Non renseigné
|
| Substances actives : |
|
|
|
Pour les composants suceptibles d'entrer en contact avec le patient et/ou les produits administrés, précisions complémentaires
|
| Latex : |
Non |
| Phtalates : |
Non |
| Origine animale ou biologique : |
Non |
| Dispositifs et accessoires associés (consommables captifs notamment) : |
| Fibres optiques SlimLine ou Moses |
| 2.9 |
Domaines et indications (selon nomenclature Euro-Pharmat) : |
| Domaines : |
|
|
| Indications (Informations complémentaires au paragraphe 6) : |
|
|
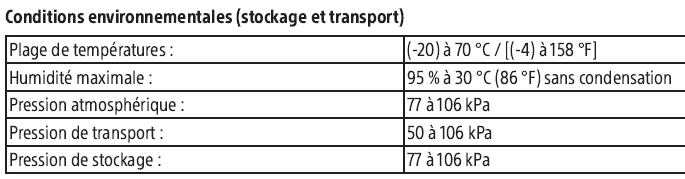
| 4. Conditions de conservation |
| |
Conditions normales de conservation et de stockage : |
| cf section Images |
| Précautions particulières : |
| Voir chapitre Sécurité du manuel utilisateur |
| Durée de validité du produit : |
| |
| Présence d'indicateurs de température (s'il y a lieu) : |
| |
| 5. Sécurité d'utilisation |
| 5.1 |
Sécurité technique : |
| |
| 5.2 |
Sécurité biologique (s'il y a lieu) : |
| |
| 6. Conseils d'utilisation |
| 6.1 |
Mode d'emploi : |
| |
| 6.2 |
Indications (destination marquage CE) : |
| |
| 6.3 |
Précautions d'emploi : |
| |
| 6.4 |
Contre indications (absolues et relatives) : |
| |
| 7. Informations complémentaires sur le produit |
| |
Informations complémentaires : |
| |
| 8. Documents annexés au dossier DM |
| |
|
| 9. Images (photos, étiquettes...) |
| |


|
Télécharger PDF Creator pour imprimer au format PDF
|